El dióxido de carbono (CO2) y el pH del agua.
Marius van Heiningen
PRÓLOGO.
También se recomienda de leer este artículo en pdf, porque en este formato las formulas no se cambian. Para hacerlo, pinchar en el título.
INTRODUCCIÓN.
El dióxido de carbono (CO2) es un gas natural que forma parte del aire que respiramos y cuyo contenido actualmente (octubre 2010) es un 0,039 por ciento. También es denominado como gas carbónico o anhídrido de carbono, aunque estos nombres están cada vez más en desuso. Aunque se trata de un gas traza (gas presente en pequeñas cantidades), su omnipresencia hace que toda agua presente en la atmósfera entre en contacto con el.
Y .....¿Que pasa cuando agua está en contacto con el gas dióxido de carbono?
La respuesta es que parte del gas se disuelve dentro del agua, donde forma el ácido carbónico (H2CO3), un ácido capaz de disolver caliza. La capacidad de disolución de caliza por agua ácida depende de la cantidad del gas que se haya disuelto en ella.
Además, el contenido de dióxido de carbono en el aire del suelo es mucho más elevado, desde un 0,039% hasta un 20 %, en casos muy especiales, lo que significa que el agua del suelo tiene mucha más capacidad para disolver caliza.
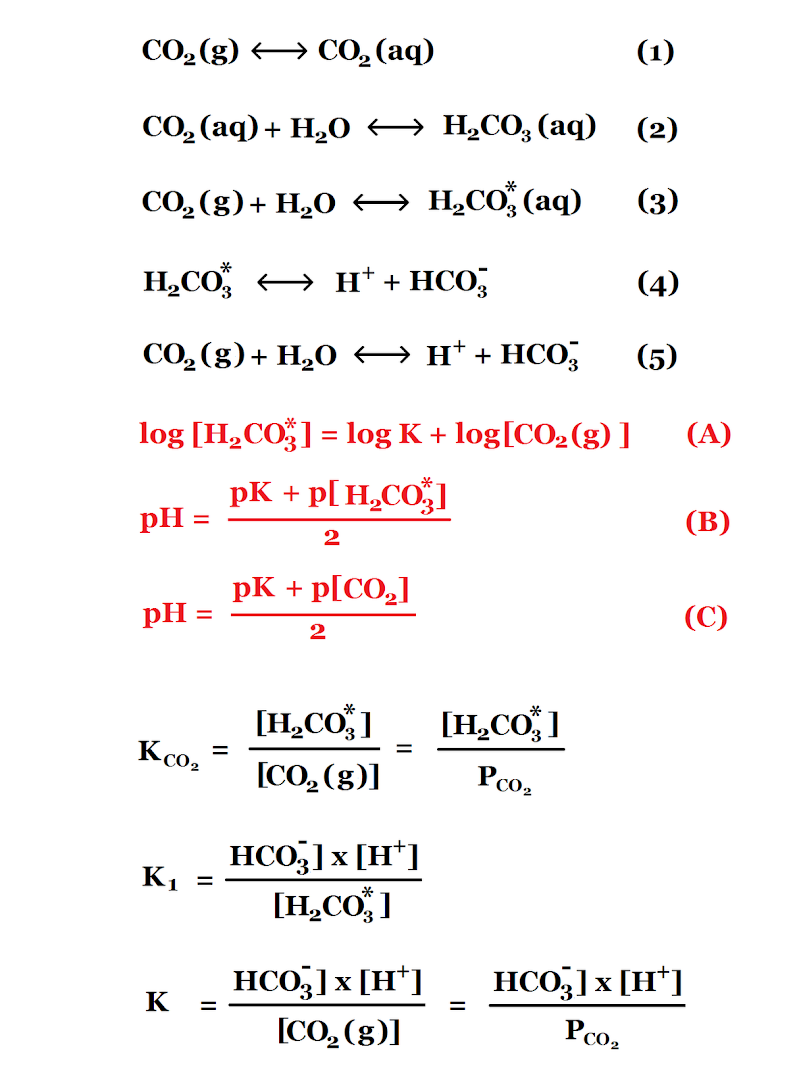
La figura 1 muestra las formulas más importantes de este artículo.
LA DISOLUCIÓN DE DIÓXIDO DE CARBONO EN AGUA.
LA FORMACIÓN DE ÁCIDO CARBÓNICO.
El gas dióxido de carbono presente en el aire y en el suelo, puede pasar a la superficie del agua. Una vez en el agua, las moléculas de dióxido de carbono son hidratadas, es decir que se encuentran rodeadas por moléculas de agua, en una relación muy estrecha. Este proceso de hidratación es lento. En formula:
CO2(g) ↔ CO2 (aq) (1)
Solo una pequeña fracción (algunas milésimas) del dióxido de carbono hidratado reacciona con el agua, formando el ácido carbónico (H2CO3). En formula:
CO2(aq) + H2O ↔ H2CO3 (aq) (2)
Como es imposible de distinguir entre H2CO3 (ácido carbónico) y CO2(aq) (dióxido de carbono disuelto o hidratado), se indica todo el conjunto con H2CO3*, indicado con un asterisco (*).
Resumen: el H2CO3* consiste en su mayoría de dióxido de carbono disuelto y una pequeña cantidad de ácido carbónico.
Si juntamos las reacciones (1) y (2) obtenemos la reacción:
CO2(g) + H2O ↔ H2CO3* (aq) (3)
A partir de ahora solo usamos el (aq) y el (g) para distinguir entre CO2 disuelto y el CO2 gas del aire. La constante de equilibrio:
[H2CO3* ] [H2CO3* ]
KCO2 = --------------- = -----------------
[CO2(g)] PCO2
La constante de esta reacción se suele indicar como KCO2(ver tabla 2 por valores de pKCO2 ), y PCO2 es la presión parcial del CO2 en el aire, que es lo mismo que [CO2 (g)].
LOS ACTORES QUE INFLUYEN EN LA CONCENTRACIÓN DEL H2CO3* .
Ahora que sabemos que el dióxido de carbono se disuelve en agua formando el ácido carbónico, nos interesa saber de que factores depende su concentración.
En primer lugar la concentración es proporcional con la presión parcial del CO2 (g).
En segundo lugar depende de la temperatura: cuanto más bajo es la temperatura mayor es la concentración (ver tabla 1).
La tabla 1 muestra la concentración de CO2 disuelto (en mg/L) por una solución en equilibrio, por diferentes presiones parciales y temperaturas. Por ejemplo, la [CO2(aq)] por una presión parcial de 0,05 y una temperatura de 10 ºC es 117mg/L.
Proporcional quiere decir que existe una relación linear entre los valores. Por ejemplo, compara los siguientes valores de concentración de dióxido de carbono disuelto: 3,36 y 33,6 y 336 (en la columna de 0 ºC) con sus respectivas presiones parciales de 0,001, 0,01 y 0,1. La relación está clara: si uno de los dos aumenta X veces, el otro también.
COMO CALCULAR LA CONCENTRACIÓN DEL DIÓXIDO DE CARBONO DISUELTO.
Un ejemplo:
Tenemos una solución que está en equilibrio con una presión parcial de 0,0003.
La temperatura es 0 ºC, y a esta temperatura la pK = 1,12 (ver tabla 2).
Hay que calcular la concentración de CO2 (aq), en mg/L.
Solución del problema:
Vamos a describir todo paso por paso.
Empezamos con escribir la ecuación de la reacción:
CO2 (g) + H2O ↔ H2CO3* (3)
Su constante de equilibrio en formula:
[H2CO3* ]
KCO2 = -------------- entonces: KCO2 x [CO2(g)] = [H2CO3* ]
[CO2(g)]
Cambiamos derecha y izquierda, y cogemos el logaritmo de ambos lados:
log [H2CO3* ] = log ( KCO2 x [CO2(g)] )
Recuerda que log (A x B) = log A + log B, entonces:
log [H2CO3* ] = log KCO2 + log [CO2(g)]
Conocemos el pKCO2 y la presión parcial PCO2(g) de la reacción:
pKCO2 = 1,12 entonces: -logKCO2 = 1,12 entonces: logKCO2 = -1,12
PCO2(g) = [CO2(aq)] = 0,0003 ó log 0,0003 = -3,52
Lo que nos da:
log [H2CO3* (aq)] = -1,12 – 3,52 = - 4,64 entonces:
[H2CO3* ] = 10 exp -4,64 = 2,29 x 10 exp -5 mol/L
Recordamos que la [CO2(aq)] es prácticamente igual a la [H2CO3* ], por tanto:
[CO2(aq)] = 2,29 x 10 exp -5 mol/L
La masa molar de CO2 es 44 (12 + 16 +16), lo que significa que la masa de 1 mol CO2
son 44 gramos. Por tanto:
2,29 x 10 exp -5 mol/L = 44 x 2,29 x 10 exp -5 g/L = 0,00101 g/L = 1,01 mg/L
La respuesta es que hay 1,01 mg/L CO2 disuelto en la solución.
Comprobando con la tabla 1 indica que nuestra repuesta es....... correcta.
RESUMEN DEL CÁLCULO.
El ejemplo anterior se puede reducir al siguiente resumen:
CO2 (g) + H2O ↔ H2CO3* (3)
[H2CO3* ]
KCO2 = -------------- entonces:
[CO2(g)]
[H2CO3* ] = K x [CO2(g)] entonces:
log[H2CO3* ] = logK + log[CO2(g)] (A)
Que se puede resolver si se sabe 2 de los 3 variables.
Por tanto podemos calcular:
La concentración de H2CO3* si se sabe la K (o pK ) y la presión parcial.
La K si se sabe la [H2CO3* ] y la presión parcial.
La presión parcial si se sabe la [H2CO3* ] y la K.
Además la [H2CO3* ] es prácticamente igual a la [CO2(aq)]
La tabla 2 muestra los valores pK de varias reacciones, por diferentes temperaturas.
pKCO2 es de la reacción 3: CO2 (g) + H2O ↔ H2CO3* (aq)
pK1 es de la reacción 4: H2CO3* ↔ H+ + HCO3-
pK es de la reacción 5: CO2 (g) + H2O ↔ H+ + HCO3-
LA DISOCIACIÓN DE ÁCIDO CARBONICO EN H+ y BICARBONATO.
El ácido carbónico es un ácido, lo que quiere decir que se disocia (se separa) en un H+ y un anión. En este caso se forma el anión bicarbonato (HCO3- ). En formula:
H2CO3* ↔ H+ + HCO3- entonces (4)
[HCO3- ] x [H+ ]
K1 = -------------------------
[H2CO3*]
La constante de esta reacción se suele indicar como K1 y la tabla 2 muestra diferentes valores de pK1 según la temperatura.
Usando las ecuaciones 3 y 4 podemos calcular el pH de una solución por cualquier presión parcial de dióxido de carbono. Suponiendo que sabemos las constantes de las reacciones (buscar en las tablas).
UN EJEMPLO.
En el artículo “Changes in Rainwater pH associated with Increasing Atmospheric Carbon Dioxide after the Industrial Revolution” por Robert A. J. Bogan et al, se menciona una presión parcial del dióxido de carbono de 700 ppm (0,0007). Según ellos el pH correspondiente a 25 ºC es 5,49. Vamos a ver si podemos llegar a la misma conclusión:
Vamos a describirlo con todo detalle.
Primer paso:
Necesitamos saber la [HCO3- ].
Arriba hemos visto que:
log[H2CO3* ] = logK + log[CO2(g)] (A)
La tabla 2 muestra que a 25 ºC la pK = 1,47 entonces: logK = -1,47
Mientras log[CO2(g)] = log 0,0007 = -3,15
Substituyendo los valores en la ecuación:
log[H2CO3* ] = -1,47 –3,15 = -4,62 entonces: [H2CO3* ] = 10 exp -4,62 = 2,40 x 10 exp -5 mol/L
Segundo paso:
El ácido carbónico se disocia en H+ y bicarbonato (ecuación 4):
H2CO3* ↔ H+ + HCO3- (4)
Aquí podemos ver que la [H+ ] = [HCO3- ].
La constante de la reacción es:
[HCO3- ] x [H+ ]
K1 = -----------------------
[H2CO3*]
Donde se puede sustituir [HCO3- ] por [H+ ]:
[H+ ] x [H+ ]
K1 = ------------------ entonces: [H+ ] x [H+ ] = K1 x [H2CO3*] entonces:
[H2CO3*]
log [H+ ] + log [H+ ] = log K1 + log [H2CO3*] entonces:
2 log [H+ ] = log K1 + log [H2CO3*]
La tabla 2 muestra que a 25 ºC la pK1 = 6,35 entonces: log K1 = -6,35
Mientras que en el primer paso hemos calculado que log[H2CO3* ] = -4,62
Substituyendo los valores en la ecuación:
2 log [H+ ] = -6,35 –4,62 = -10,97 entonces: log [H+ ] = -5,49 entonces: pH = 5,49
Nuestra resultado coincide con el valor calculado por Robert Bogan et al.
RESUMEN DEL CÁLCULO.
El ejemplo anterior se puede reducir al siguiente resumen:
En el primer paso se calcula el log[H2CO3* ] usando la ecuación:
log[H2CO3* ] = logK + log[CO2(g)] (A)
En el segundo paso se sustituye [HCO3- ] por [H+ ] en la constante de equilibrio, obteniendo:
[H+ ] x [H+ ]
K1 = ------------------ entonces: [H+ ] x [H+] =K1 x [H2CO3*]
[H2CO3*]
Aplicando el logaritmo a ambos lados:
2 log [H+ ] = log K1 + log [H2CO3*]
Dividir por –2, (p = -log) lo que da como resultado final:
pH = (pK1 + p[H2CO3*] ) / 2 (B)
Donde se sabe pK1 y se ha calculado log [H2CO3*]
METODO ALTERNATIVO.
INTRODUCCIÓN Y DERIVACIÓN DE FORMULA PARA pH.
Si consideramos las ecuaciones 3 y 4
CO2 (g) + H2O ↔ H2CO3* (3)
H2CO3* ↔ H+ + HCO3- (4)
Se ve que se puede juntar en una sola ecuación:
CO2 (g) + H2O ↔ H+ + HCO3- cuya constante es: (5)
[HCO3- ] x [H+ ] [HCO3- ] x [H+ ]
K = ---------------------- = ---------------------- sabemos que [CO2 (g) ] = PCO2
[CO2 (g) ] PCO2
[H+ ] x [H+ ]
K = ------------------ entonces: [H+ ] x [H+] = K1 x PCO2 aplicar logaritmo a ambos lados:
PCO2
2 log [H+ ] = log K + log [CO2 (g)] entonces:
pH = ( pK + p [CO2 (g)] ) / 2 (C)
Donde K se refiere a la constante de la reacción 5.
DETERMINACIÓN DE LA CONSTANTE DE ESTA REACCIÓN.
Que puede ser la pK de esta reacción?
Lo que sabemos es:
[H+ ] = [HCO3- ] , pH = 5,49 y PCO2 = 0,0007.
Y con el pH se calcula [H+ ] : pH = 5,49 entonces: [H+ ] = 3,24 x 10 exp -6
Sustituyendo en la formula de la constante:
[HCO3- ] x [H+ ] 3,24 x 10 exp -6 x 3,24 x 10 exp -6
K = ---------------------- = -------------------------------------------- = 1,5 x 10 exp -8 entonces: pK =7,82
PCO2 0,0007
NOTA:
Ya hemos visto que el pKCO2 de la reacción 3 es 1,47 y el pK1 de la reacción 4 es 6,35.
Si juntamos ambos pK : 1,47 + 6,35 = 7,82.
Se ve que coincide con la pK que acabamos de calcular, lo que afirma que este método también es válido.
APLICACIÓN DEL MÉTODO ALTERNATIVO AL MISMO EJEMPLO.
Vamos a calcular otra vez el pH para la [CO2 (g)] = 0,0007 (ejemplo anterior).
pH = ( pK + p[CO2 (g)] ) / 2 (C)
donde la [CO2 (g)] = 0,0007 entonces
p[CO2 (g)] = 3,15 y la pK = 7,82
Sustituyendo los valores en la ecuación:
pH = ( 7,82 + 3,15 ) / 2 = 10,97 / 2 = 5,49 lo que coincide.
NOTA 1: Está clara que el método alternativo es mucho más rápido, pero en este artículo se trata de explicar como se llega a los resultados, y una vez entendido se puede aplicar las formulas derivadas.
NOTA 2: Hemos supuesto que la [H+ ] = [HCO3- ] porque el H2CO3* se disocia en cantidades iguales de H+ y de bicarbonato. Sin embargo, en un artículo anterior hemos visto la reacción:
2 H2O ↔ H3O+ + OH- donde también se forma cierta cantidad de H+ . Entonces se puede concluir que la [H+ ] es mayor de lo que suponemos.
Sin embargo, en agua pura el pH = 7, y por tanto la [H+ ] = 1 x 10 exp -7 .
En una solución ácida, esta concentración es todavía menor (efecto de ión común), mientras que las concentraciones de H+ debido a la disolución de dióxido de carbono suelen ser (bastante) mayor de 1 x 10 exp -7 . Por tanto, la [H+ ] debido a la asociación de agua es insignificante.
VARIACIONES EN NIVEL DE DIÓXIODO DE CARBONO.
En octubre 2010 el porcentaje de dióxido de carbono en el aire era 0,0339 por ciento. Este porcentaje puede parecer muy pequeño, sin embargo hace unos 100 años solo era aproximadamente 0,03.
Este aumento es debido a la acción del hombre, por un lado por la combustión de carbón, petróleo y gas y por otro lado por la destrucción de bosques y suelos que tienen gran capacidad para fijar el dióxido.
Este artículo no trata de las causas del cambio climático, sin embargo, las fluctuaciones de los niveles de dióxido de carbono han influido directamente en la capacidad de disolución de las aguas de precipitación. Las fluctuaciones de los últimos cientos de miles de años tienen una estrecha relaciones con la edades de hielo.
RESUMEN.
La caliza es disuelto por agua ácida y la acidez del agua depende normalmente de la presión parcial del dióxido de carbono en el aire, y sobre todo del aire presente en los suelos. El dióxido del aire se disuelve en agua donde se forma el ácido carbónico (H2CO3*). La indicación con el asterisco indica que la mayoría de este ácido se encuentra en forma de dióxido de carbono disuelto (hidratado). El ácido carbónico se disocia en H+ y bicarbonato (HCO3- ), según la reacción 4.
Por tanto se trata de las siguientes concentraciones:
[CO2(g)], [H2CO3*], [HCO3- ] y [H+ ].
La [CO2(g)] también se puede escribir como: PCO2 (P de presión parcial).
La [H2CO3*] coincide con el dióxido carbono disuelto [CO2(aq)].
En soluciones naturales prácticamente todo el bicarbonato y el H+ provienen de la disociación de ácido carbónico, y por tanto sus concentraciones son prácticamente iguales: [HCO3- ] = [H+ ].
La forma de expresar la acidez de una solución es tomando el logaritmo negativo (-log) de la concentración de H+ , lo que se indica con corchetes: [H+ ]. El logaritmo negativo se llama p, y por tanto –log [H+ ] = pH.
Las reacciones principales son:
CO2 (g) + H2O ↔ H2CO3* (3)
H2CO3* ↔ H+ + HCO3- (4)
La reacción (3) describe la disolución del gas dióxido de carbono en agua, donde forma ácido de carbono, mientras que la reacción (4) describe la disociación del ácido de carbono en H+ y bicarbonato. Ambas reacciones se pueden resumir en la reacción (5):
CO2 (g) + H2O ↔ H+ + HCO3- (5)
Todas las reacciones del sistema dióxido de carbono y agua son reacciones de equilibrio, lo que implica que cada reacción tiene su constante de equilibrio K.
Los valores de K (o pK) para cada reacción y por diferentes temperaturas se pueden encontrar en las tablas.
En los ejemplos se han derivado unas formulas que son muy útiles para todos los cálculos. Estas formulas derivadas son:
log[H2CO3* ] = logK + log[CO2(g)] (A)
pH = (pK1 + p[H2CO3*] ) / 2 (B)
pH = ( pK + p[CO2 (g)] ) / 2 (C)
Ahora, suponiendo que las reacciones están en equilibrio y que solo se trata del sistema de dióxido de carbono y agua (sin presencia de otras materias) se puede calcular:
Sabiendo el pH, se puede calcular directamente [H+ ] y [HCO3- ], además la p[CO2 (g)] usando la formula (C) y [H2CO3*] usando la formula (B).
Sabiendo la [H2CO3*] se puede calcular la [CO2(g)],usando la formula (A), y viceversa, sabiendo la [CO2](g)] se puede calcular la [H2CO3*], usando la misma formula.
Sabiendo la [H2CO3*] se puede calcular el pH (y por tanto las [H+ ] y [HCO3- ] ), usando la formula (B).
Sabiendo la [CO2 (g)] se puede calcular el pH (y por tanto las [H+ ] y [HCO3- ] ), usando la formula (C).
En otras palabras: con solo saber una de las concentraciones se puede calcular las concentraciones de las demás (siempre que se pueden conseguir las constantes por la temperatura y reacción adecuadas).


No hay comentarios:
Publicar un comentario